脂肪由来幹細胞をベースとしたデザイナー細胞による画期的治療の開発
神経疾患のなかでも患者数が多く、要介護の原因となる主疾患である脳梗塞では、これまでの治療法では限界があり、新規治療法の開発が必要とされています。これまでの研究で、脳梗塞後の炎症制御と神経突起伸張の促進作用が脳梗塞後の予後改善にとって必要であることが分かっており、薬剤や間葉系幹細胞移植など様々な治療法が試されましたが効果は限定的でした。最近の報告では、間葉系幹細胞移植による治療反応性には個人差が大きく、移植後の血中細胞外小胞の量と質が効果発現にとっては重要であること、また、高齢者の間葉系幹細胞では若年者に比較して肝細胞増殖因子(HGF)などの栄養因子や神経再生を促進するmiRNA量が低下し、炎症や老化に関連するmiRNAの発現が増加していることも報告されています。したがって、脳梗塞のような高齢者が多い疾患における間葉系幹細胞の治療では、治療にとって必要とされる機能を付加した間葉系幹細胞の開発は重要であると考えられます。
我々はこれまでHGFやR-spondin(RSPO)の研究を重ねてきました。具体的には、遺伝子導入にて脳梗塞後にHGFを脳内に過剰発現することにより、神経突起新生と微小循環改善により脳梗塞慢性期の認知機能障害が改善されることを見いだし [1]、また、Wnt/βカテニンシグナルの促進因子であるRSPOが、脳梗塞の麻痺を改善する新たな分子である可能性を見いだしています [2]。
このような背景から、当研究室では前述のHGFやRSPOのような分子と、障害部位への集積を促進する遺伝子を導入した脂肪由来幹細胞を、株式会社ASメディカルサポートとの共同研究にて新たに作成し、脳梗塞や脊髄損傷、自己免疫疾患における新たな治療法としての応用を目指しています。
新規炎症制御/神経再生分子の探索と脳梗塞・難治性疾患治療への展開
我々は既存の分子をターゲットにしたこれまでの脳梗塞治療法の開発には限界があることから、炎症制御や神経突起伸張に関わる新規分子の探索を行ってきました。その一つとしては前述のRSPOと、脳梗塞後の活性化ミクログリアに発現し、TLRによる炎症を制御するRANKL/RANKシグナルを見いだしました [図1、3]。
さらに、RANKLのRANKとの結合部位のうち、破骨前駆細胞の分化に関与する部位を除いた部分ペプチドが、ミクログリアやMφにおけるTLRシグナルに関する炎症を強力に抑制することを見いだし、脳梗塞急性期の治療薬としての可能性を見いだしました [4, 5、図2]。本ペプチドはTLR炎症が関連する敗血症、乾癬、肺線維症でも治療効果を認めており[6,-8]、現在、ペプチドをより効果的にするために、徳島大学との共同研究を進めています。
また、間葉系幹細胞の効果発現にとって重要であるWnt/βカテニンシグナルの促進因子であるRSPOについても、新たにTLR炎症抑制と神経突起伸張により脳梗塞の麻痺を改善することを新たに見いだしています [2, 図3]。
これらの発見にとどまらず、多角的な視野から脳梗塞の治療にとって有望な新規分子の探索に取り組んでいきたいと考えています。
腫瘍免疫機構の解明による新規癌治療法開発への挑戦
がんは免疫システムから逃れるために様々な細胞を利用し、腫瘍微小環境(TME:Tumor microenvironment)とよばれるがんにとって心地よい環境を形成します。TMEでは腫瘍増殖関連因子が産生され、抗腫瘍免疫が抑制されるために、がんがますます悪化していきます。近年、様々ながん免疫療法が開発されていますが、その治療効果は腫瘍微小環境に左右されます。したがって、良好な治療効果を得るためには腫瘍微小環境の免疫抑制性を解除する必要があります。
我々は腫瘍微小環境の研究により、がん治療の新たな可能性を探求しています。具体的には、免疫賦活剤や分子薬を用いてTMEを刺激し、抗腫瘍免疫の抑制を解除することによって抗腫瘍免疫を増強し、PD-1抗体療法の抵抗性を解除します(図4)。また、全細胞がんワクチンの製剤工程を改良し、自己免疫寛容の解除、抗腫瘍免疫応答誘導を効率的に誘導できる次世代のがんワクチンを開発し、がんの転移と再発を防ぐことを目指しています(図5)。本研究は張今陽が中心に行っています。
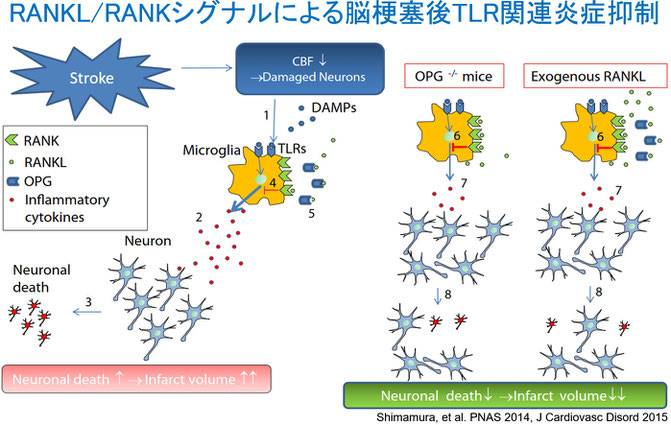
図1 RANKL・RANKは脳梗塞後の活性化ミクログリアに発現し、RANKL/RANKシグナルの増強は脳梗塞後のTLR炎症を抑制し、脳梗塞後の悪化を抑制する。

図2 RANKL部分ペプチドの作用機序 RANKL部分ペプチドは破骨前駆細胞の分化を促進することなく、TLR炎症を抑制する。
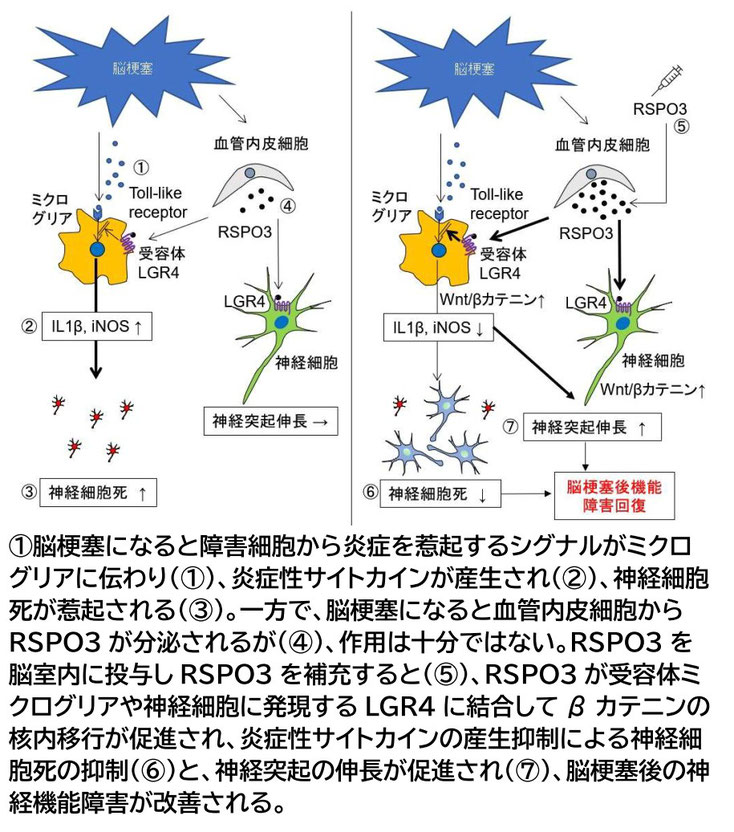
図3
脳梗塞におけるRSPO3の作用

図4

図5
参考文献・学会発表
- Shimamura M, et al. Hypertension. 47, 742-51, 2006.
- Shimamura M, et al. Stroke 2023.
- Shimamura M, et al. PNAS. 111, 8191-6, 2014.
- Kurinami H, et al. Sci Rep. 6, 38062, 2016.
- Shimamura M, et al. Sci Rep. 8, 17770, 2018.
- Nan J, et al. Immunohorizons. 438-447, 2021.
- Nan J, et al. Sci Rep. 15434, 2019.
- Nan J, et al. Sci Rep. 12474, 2022.
